In Evidenza
L’Antitrust apre una inchiesta su un presunto abuso di posizione dominante nei confronti della azienda farmaceutica che vende i farmaci a base di acido chenodesossicolico

In Evidenza
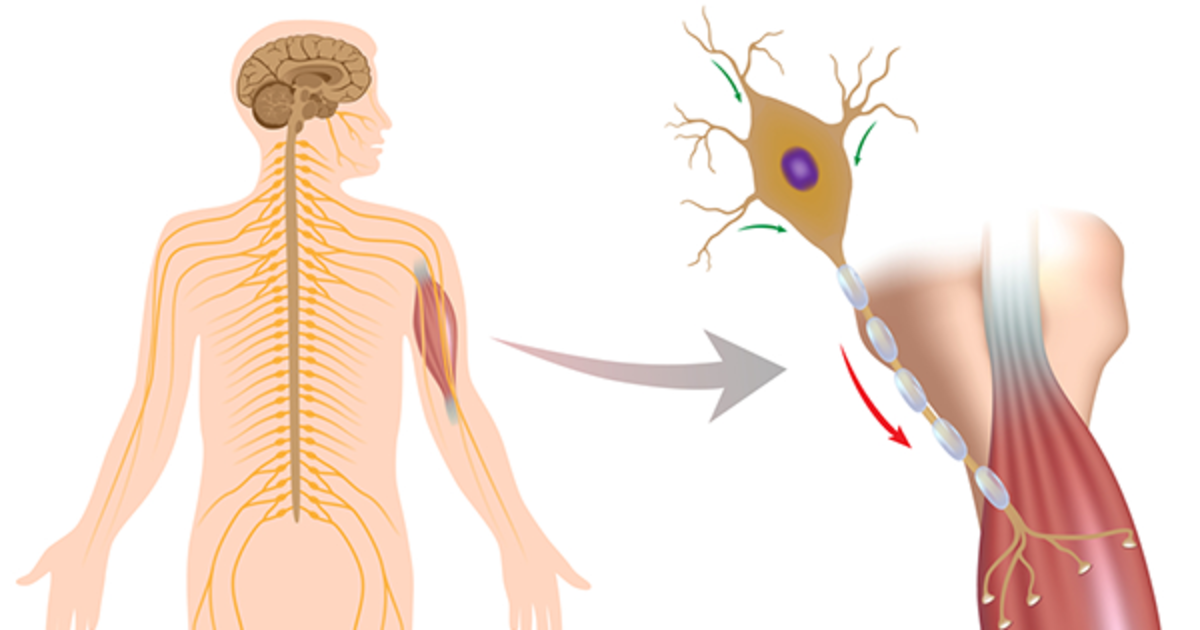
Proteine e test per diagnosi, nuove frontiere sulla Sla
Ambiente
Cop29, respinta ipotesi di aiuti per 300 miliardi
In Evidenza
Coppa Davis, Berrettini soffre ma vince: Italia 1 – Australia 0
-

 Cronache5 anni fa
Cronache5 anni faVideo hard di una ragazzina di Avellino diffuso in rete, la polizia ha già denunciato tre minorenni ma “il giro è molto più largo”
-

 Cronache5 anni fa
Cronache5 anni faMorta a 24 anni dopo aver assunto per 2 mesi integratori. Gli esperti accusano Herbalife
-

 Cronache5 anni fa
Cronache5 anni faMattarella “revoca” la concessione ai Benetton che pagano i giornali per nascondere la notizia
-

 Cronache6 anni fa
Cronache6 anni faL’orrore dei video della decapitazione delle due ragazze scandinave in Marocco, i 4 arrestati avevano giurato fedeltà all’Isis
-

 Cronache6 anni fa
Cronache6 anni faOrrore in Marocco, il video della decapitazione di due giovani turiste scandinave a pochi chilometri da Marrakech pubblicato su Facebook: presi alcuni terroristi
-

 Cronache5 anni fa
Cronache5 anni faBoss di mafia liberi, Maresca minacciato: è finito tutto, sono stato lasciato solo, non ci sto più, vado a casa
-

 Cronache5 anni fa
Cronache5 anni faAlessandro Bologna alias Franchino il criminale, il boxer che fornisce ai ragazzi le “istruzioni” anti bulli
-

 Cronache5 anni fa
Cronache5 anni faCoronavirus, dopo Zagaria anche Cutolo tornerà a casa sua ad Ottaviano: hanno paura possa contagiarsi